发布时间:2025-05-22来源:广西中医药大学附属瑞康医院作者:I期药物临床试验研究中心审核:覃华芳覃超 韦安静点击: 次
参加临床试验哦,你是让我去做小白鼠送死吧?!
你想多了!像“医美”产品的临床试验在大医院基本“挤破头”
姐妹们,你真的是吃了“没在医院上班”的亏。
免费的医用级面膜、免费法令纹除皱……
这些医美临床试验,全是正规三甲大医院才有资格送的“福利”
那到底是不是呢?

首先,临床试验是干什么的呢?
举个例子,比如消除川字纹的注射药品——肉毒素,现在市面上已经有许多安全有效的肉毒素药品可以用于注射川字纹了,而此时又有个同类的新产品要上市,这个时候,就需要通过临床试验对药物进行系统性研究,确定试验药物的疗效与安全性。
(具体做法:比如召集100个自愿受试者,随机分成两个组,用同样的方式注射,50个人打的是新药,50个人打的是旧药,这个临床试验是“双盲”的,也就是医生、受试者都不知道,哪位受试者打的是新药,哪位受试者大的是旧药。如最后的临床试验观察,两组人的川字纹都改善了,也没有出现任何副作用,那就说明新药和旧药一样,都是安全有效的。注意!哪怕是“双盲”试验,“旧药”也是该疾病里目前最好的治疗方案。)
哪些药物或者器械项目会有临床试验?
答案是几乎所有。只要是想在中国内地合规上市的药物(比如司美格鲁肽、中成药等)、注射材料(比如玻尿酸等)、医疗器械(比如人工骨、冠脉支架等)、疫苗(比如流感疫苗、HPV疫苗等),基本都需要在内地开展临床试验,它可能是国内自主研发的产品,也可能是在国外已经上市用了很多年的产品,但在引进中国内地之前,往往要先在内地做临床试验,证明它同样适合“中国宝宝的体质”。
大众对临床试验存在的误解
误区一:临床试验,是不是“试试就逝世”?
临床试验,指的是在人体上的“试”验,而在此之前,药物早已进行过体外的细胞实验、动物实验。细胞实验指的是在培养皿中,用药物对付癌细胞、细菌或者病毒等,看能不能“嘎嘎杀敌”!动物实验指的是在小鼠、犬类、猴子等动物身上,看看药物是怎么吸收、代谢以及毒性如何。
(在细胞、动物实验这两关都过了之后,药物才有资格来到人体身上,这时它们的安全性已经有了基本的保障。并且,要想真正走到人体试验,还需要得到国家药监部门的同意。)
临床试验,还分三期逐步进行
Ⅰ期临床试验:安全性的“初试”
这是新药在人体的“首次使用”,核心目标是看看这个新药会不会给人体“惹麻烦”,看看在预估的可控范围内,人体能耐受多少剂量,并观察药物在人体内吸收、分布、代谢、排泄的全过程。此阶段受试者一般为健康的志愿者,偶尔是患者,人数一般需要20-100人。
Ⅱ期临床试验:有效性的“小考”
此时药物首次进入“实战”阶段,证实这个药真的能治病吗?这个阶段的受试者一般为患者群体,人数增加到100-300人,在试验的过程中同时判断药效最佳、风险最低的情况下,最佳药品剂量是多少。
Ⅲ期临床试验——大范围对比:疗效的“终极验证”,也是判断药品是否对大部分患者都有效?
这也是三个阶段中规模最大、时间最长的临床试验阶段,需要300-5000名患者群众的受试者,这个阶段也对于新药能否获批上市起决定性作用。还需要设立对照组,把新药跟现有的标准疗法做对比,如同“大型擂台赛”,新药胜出才能获得“上市资格证”。
正因为Ⅲ期的人数最多,所以我们最容易接触到的也是Ⅲ期临床试验。在Ⅲ期临床试验之前,新药已经通过了层层把关,包括在细胞、动物、小中范围人群的试验,确定安全有效之后,才会进入到大范围的三期,其安全性和有效性都是相对较高的。因此,请放心,参加临床试验,绝不是“试试就逝世”!
(对于疑难皮肤病、“走投无路”的癌症晚期、罕见病患者来说,临床试验也许是照进黑暗的唯一的“一道光”。)
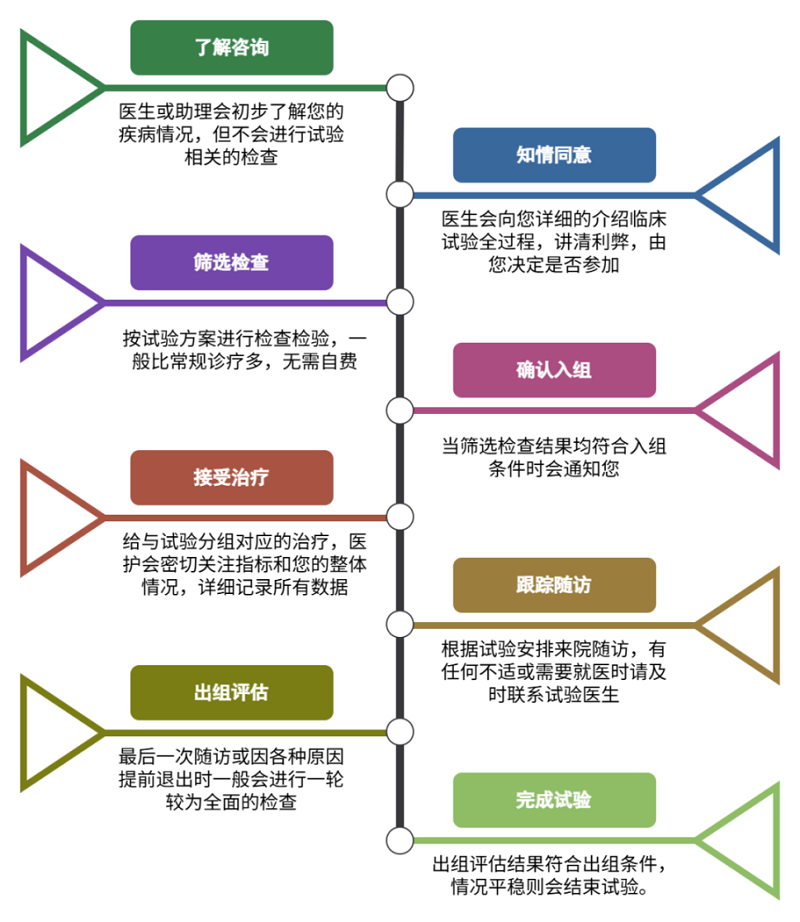
误区二:入选了就不能退出?
受试者签了知情同意书“入组”后,中途可以随时退出。
成为“受试者”,不想别人知道可以吗?
受试者不用怕自己个人信息加密存储,访问需严格授权。数据匿名化处理后用于研究,使用范围受限,过期后安全销毁。
万一出现安全风险怎么办?
临床试验需通过医院伦理委员会审查,确保风险在可控范围。一旦不良事件发生时,药企需提供免费治疗,并为受试者购买保险。
还有长期健康随访计划监测潜在延迟反应,比如抗癌药物试验后还会定期体检。
成为“受试者”,还有什么“好处”?
受试者回医院随访,试验方一般都会承担交通费、误工费等直接损失;如果因试验导致损害,申办者需赔偿医疗费、精神抚慰金等,还可能需要提供法律援助。
临床试验有医院独立伦理委员会全程监督试验方案,发现问题可叫停研究。还有国家药监局定期核查数据真实性,对造假行为坚决严惩。